
di Luca Lapini
Museo Friulano di Storia Naturale, UD
Premessa
Ad ampia distribuzione euro-asiatica, lo sciacallo dorato (Canis aureus) è diffuso in Europa, Asia Minore, Medio Oriente (Egitto escluso), India e Asia sud-orientale almeno fino a Cambogia e Laos. Politipico, è stato suddiviso in numerose sottospecie, alcune delle quali sono state da poco elevate a rango specifico. Studi biomolecolari, filogeografici e la distribuzione dei suoi resti sub-fossili indicano chiaramente che lo sciacallo dorato è un invasore post-glaciale dell’Europa, arrivato dal Caucaso circa 8.000 anni fa (Spassov & Acosta Pankov 2019). Attualmente esso vive una fase di grande espansione in tutta Europa, originariamente partita da tre nuclei popolazionali: (I) la parte orientale del Caucaso, (II) la parte orientale della Transcaucasia e (III) le coste dalmate dei Balcani (Spassov & Acosta Pankov 2019). Questa impressionante espansione è sicuramente dovuta ad influenze antropiche (Trowborst et al. 2015), soprattutto dovuta alla decimazione del lupo in tutta Europa, culminata attorno agli anni ‘50 del XX secolo (Krystufek et al. 1997; Krofel et al., 2017). Il lupo, infatti, è il principale antagonista dello sciacallo dorato in natura.


La situazione di Canis aureus in Italia
In Italia è diffusa la maggiore sottospecie vivente di questo canide selvatico, che di rado supera i 15 kg. Si chiama sciacallo dorato europeo (Canis aureus moreoticus), originariamente descritto su materiale proveniente dalle coste greche (Terra Typica: Morea/Peloponneso, Grecia) da G. Saint Hilaire nel 1835.
Storia della colonizzazione
Il primo dato certo di presenza accertata di Canis aureus nell’Italia nord-orientale risale al 1984 (Regione Veneto), ma la prima riproduzione è stata certamente documentata soltanto nel 1985 (Friuli Venezia Giulia). Attualmente la specie è irregolarmente distribuita in gran parte dell’Italia settentrionale, sia su Alpi e Prealpi, sia nelle bassure della Pianura Padana. Nel Bacino Padano esso è ormai diffuso da Ovest (Piemonte) ad Est (Friuli Venezia Giulia) e da Nord (Trentino – Alto Adige) a Sud (Emilia Romagna). Eventi riproduttivi sono stati accertati in gran parte di quest’area, con l’apparente eccezione della Lombardia e del Piemonte. Attualmente in Italia vivono 200-210 esemplari di Canis aureus, ma la loro grande localizzazione li espone ad elevato rischio di estinzione stocastica, aumentata dalla locale coabitazione coi lupi. Non sembra un caso che il numero più elevato di gruppi riproduttivi della specie sia concentrato nel Friuli Venezia Giulia, la Regione italiana con il minor numero di lupi (attualmente 20-25 esemplari suddivisi in 2-4 branchi), tornati in quest’area soltanto nel 2013 (Lapini et al., 2014). In Italia e nei paesi europei di recente colonizzazione l’acquisizione di nuove informazioni distributive su Canis aureus deve seguire il protocollo di Hatlauf et al. (2016), visto che in queste zone il piccolo canide viene regolarmente confuso con volpe e lupo (Lapini et al., 2011, 2018, 2020).
Per questa ragione è stato realizzato un sito informativo, liberamente disponibile (Canis aureus news), appositamente dedicato al public awareness e continuamente aggiornato sulle ricerche in corso, da cui è tratta la sintesi distributiva che segue (https://drive.google.com/drive/folders/1slP3zPaF2L7me7pamP28nUTnxHo98QtS).
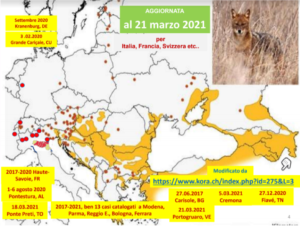
(https://drive.google.com/drive/folders/1slP3zPaF2L7me7pamP28nUTnxHo98QtS)
Preferenze ambientali
In Italia la specie vive tra il livello del mare (delta del Fiume Isonzo, Gorizia, Friuli Venezia Giulia) e i 2600 m s. l. m. (Monte Motto sopra Livigno, Lombardia: Lapini, 2019), ma gli ambienti selezionati dalla specie sono in genere situati sotto i 400 m di quota.
In quest’area la specie preferisce ambienti arbustivi o forestali, paludi e alvei fluviali, boscaglie golenali, agro-ecosistemi. Frequenta talora città (Udine; San Donà di Piave, Venice; Pordenone; Verona) e paesi sia in Provincia di Udine (Pozzuolo del Friuli, Pavia di Udine, Percoto, Fiumicello, Savorgnano del Torre, Osoppo, Preone, Esemon di sotto, ecc.), Pordenone (Cordenons, San Leonardo in Valcellina, Vajont, ecc.), Trieste (Malchina, Gropada, Padriciano, Basovizza, Sistiana, Duino Aurisina, ecc.) e Gorizia (Polazzo, Doberdò del Lago, Monfalcone, Villesse, Ronchi dei Legionari, ecc.), cercando pollame e rifiuti domestici raccolti spesso attorno a discariche pubbliche o piazzole ecologiche.
Dieta
Le informazioni sulla dieta degli sciacalli italiani sono ancora scarse. Esse sono dovute soprattutto alla dissezione di esemplari investiti, dato che gli studi di depositi fecali sono problematici perchè effettuati su fatte identificate a vista, raccolte in aree dove sciacalli, cani, volpi e lupi vivono assieme. I contenuti stomacali di soggetti investiti, d’altra parte, sono per lo più riferiti ad animali di uno-due anni e il loro spettro alimentare potrebbe essere facilmente condizionato dalla giovane età media.
In una sessantina di stomaci finora esaminati è stata rinvenuta una gran quantità di rifiuti e resti vegetali; tra questi ultimi sono molto frequenti foglie di Graminaeae, cariossidi di Zea mais, olive di Olea europaea, siconi di Ficus carica, frutta dolce di origine domestica o selvatica (Rubus sp., Morus alba e Morus nigra, Vitis vinifera, Prunus avium, Prunus domestica, Malus domestica, Diospyros kaki); invertebrati: Gordiidae (talora in grandi quantità, probabilmente per via del consumo di Orthoptera), Annelida (Lumbricidae), Insetti dei più diversi gruppi (Orthoptera, Coleoptera, Diptera); vertebrati: Pesci (Salmonidae, Cyprinidae), Rettili (Podarcis, Hierophis), Mammiferi (Talpa, Crocidura, Microtus, Apodemus, Rattus, Glis, Arvicola, Lepus, Myocastor, Vulpes, Canis, Felis, Martes, Oryctolagus, Lepus, Sus scrofa selvatico e domestico, Capreolus/Cervus, Ovis, Capra, Bos), Uccelli (Anatidae, Galliformes, Passeriformes, Corvidae). Grandi mammiferi (Suidae, Cervidae e Bovidae), Carnivori (Canis, Vulpes, Felis) e resti di pollame, tuttavia, sono spesso mescolati a resti di insetti necrofagi; ciò vuol dire che essi sono consumati recuperandoli dopo la morte. Nello stomaco di un soggetto recentemente investito sul Carso goriziano sono stati rinvenuti circa tre etti di sterco fresco di ruminante (vacca).
Una fonte importante di queste risorse di origine animale è certamente la mortalità stradale. La necrofagia su carcasse da road mortality potrebbe da un lato spiegare l’elevata mortalità stradale degli sciacalli italiani, dall’altro alcuni casi di cannibalismo (ingestione di alcune parti di Canis aureus), così come l’utilizzo di resti di Vulpes vulpes, indicata dall’ingestione di porzioni di questo canide. La predazione volontaria di Martes foina, al contrario, è stata recentemente dimostrata dal foto-trappolaggio (Pecorella & Lapini, 2015). Le più importante fonti di parti di grandi mammiferi nella dieta degli sciacalli italiani, in ogni modo, sono certamente i resti di cacciagione da macellazione venatoria, dato che gran parte dei resti di ungulato estratti dagli stomaci di Canis aureus sono tagliati col coltello e invasi da insetti necrofagi.
Rapporti con l’uomo e note sinecologiche
Nonostante quanto più sopra riferito la pubblica percezione della specie è spesso cattiva (Carso goriziano e triestino) particolarmente per l’errata convinzione che la presenza di sciacalli riduca la densità di caprioli. I dati presentati dallo specialista di caprioli Franco Perco ad un recente convegno venatorio (Conv. Agjso, Trieste, 24-26.X.2019), tuttavia, non confermano questa supposizione, indicando al contrario una chiara correlazione inversa tra abbondanza di capriolo e cinghiale nelle piccole riserve di caccia del Carso italiano nel periodo 1978-2018 (Lapini, 2019). Queste interazioni negative fra le due specie sono localmente culminate nel 2011-2012, quando l’impressionante crescita dei prelievi di cinghiale ha incrociato la decrescita locale dei prelievi di capriolo. Questi dati confermano su scala locale analoghe indicazioni riferite alla Svezia (Melberg, 2012). Nonostante ciò, la percezione della specie presso gli agricoltori e i cacciatori del Carso triestino e goriziano è pessima ed ha anche portato alla recente dispersione di esche avvelenate con pesticidi (Bregoli et al., 2018) che hanno ucciso almeno tre esemplari. Del resto è il caso di sottolineare che dei risarcimenti erogati dall’Amministrazione della Regione Friuli Venezia Giulia nel periodo 2009-2020 per danni zootecnici da lince, orso, lupo e sciacallo dorato (totale al 17 giugno 2020: 86.300 €), soltanto l’1,4% è stato attribuito a sciacallo. Si trattava di due agnelli predati e due asine sottoposte ad eutanasia per via di alcune ferite alla vulva forse dovute a morsi di sciacallo.
Canis aureus può essere definito “opportunistic forager” (raccoglitore opportunista) piuttosto che predatore (Lange et al., 2021). Il consumo di pecore e caprioli è stato talvolta osservato anche in Italia, ma la vera causa della loro morte in realtà non è mai stata dimostrata. Nonostante ciò la predazione su ungulati debilitati sembra talora possibile; Lapini (2003) cita la predazione di caprioli in difficoltà nella neve alta (San Vito di Cadore, Provincia di Belluno).
I dati su dimensioni ed utilizzo degli home range familiari degli sciacalli europei sono ancora pochi ma indicano situazioni piuttosto variabili a seconda delle risorse localmente disponibili (Fenton et al., 2021).
Survey bio-acustiche e campagne di camera-trapping indicano che i gruppi riproduttivi di Canis aureus in Italia sono costituti da 3-7 esemplari. Un tipico gruppo familiare nel nostro paese, comunque, è più spesso composto da 5 esemplari (in media 5,3): due-tre cuccioli, una sorella di un anno col ruolo di helper e la coppia riproduttiva. Dati sugli Home Range di questi gruppi familiari sono ancora scarsi. Un gruppo riproduttivo sembra dominare su 250-500 ettari, ma nel corso dell’estate le dimensioni dell’area difesa dal gruppo tende a contrarsi. Dai dati disponibili sembra chiaro che in Italia la nascita dei cuccioli avviene in aprile-maggio. I cuccioli escono dalla tana dopo 40-45 giorni, ma soltanto all’inizio di luglio essi formano un vero e proprio branco di giovani. Essi sono guidati da una sorella dell’anno precedente muovendosi per lo più nel centro dell’Home Range familiare. I loro genitori sono abbastanza indipendenti dal gruppo giovanile, muovendosi fino ai confini più estremi dell’Home Range. In novembre, comunque, la coppia riproduttiva si separa dal gruppo giovanile, iniziando un lungo periodo di corteggiamento. Esso dura fino a febbraio, quando compare una tipica figura di corteggiamento a T che precede di poco la copula e la fecondazione. In Italia la tana riproduttiva della specie è di regola scavata dal tasso (Meles meles).
La competizione triangolare intra-guild (intra categoria trofica) tra volpe, sciacallo dorato e lupo sicuramente avviene anche in Italia. Nell’Italia nord-orientale almeno due sciacalli dorati sono stati uccisi dai lupi, sia in provincia di Pordenone (Lapini et al., 2018), sia di Bolzano (Aukenthaler, 2019). Nonostante ciò in alcune aree a bassa densità popolazionale dell’alta pianura pordenonese (i Magredi) sciacalli dorati e lupi sono vissuti assieme, almeno nel periodo 2016-2019. In quest’area, comunque, lo sciacallo dorato ha smesso di rispondere alle stimolazioni acustiche all’inizio di ottobre 2016, quando un maschio di lupo italico genotipizzato nel 2013 a Maserada di Piave (Treviso) è arrivato nella zona dei Magredi. Alla fine di dicembre 2016 una giovane femmina di sciacallo dorato è stata uccisa dai lupi vicino a Cordenons, nella parte meridionale dei Magredi in Provincia di Pordenone. Nonostante ciò le contemporanea presenza di lupi e sciacalli nell’ampia zona dei Magredi è stata verificata mediante camera-trapping almeno fino al 2019.
In questa fase dell’espansione di Canis aureus in Europa meridionale le densità stimate appaiono estremamente variabili da zona a zona (Fenton et al., 2021).
Il tasso di incremento medio annuo delle popolazioni italiane in questa fase della colonizzazione può essere stimato attorno al 15-20%. In queste zone le densità medie -finora stimate in base a survey bio-acustiche estive e camera-trapping- sono comprese tra un singolo gruppo riproduttivo/1000 ettari (0,0053es./ha: golene fluviali dell’alta Pianura udinese) e i tre gruppi riproduttivi/1000 ha (0,0159 es./ha: Carso isontino e triestino) (Lapini et al., 2020). Le densità tuttavia fluttuano nell’arco dell’anno, mostrando valori massimi in autunno.
La comunità di parassiti legati allo sciacallo dorato italiano non è ancora molto conosciuta, ma la specie sicuramente ospita alcuni endo-parassiti piuttosto rari nel nostro paese. Uno di questi è Metagonimus yokogawai (Katsurada 1912), un piccolo trematode digeneo per la prima volta rinvenuto in Italia nell’intestino di uno sciacallo dorato del Carso triestino da P. Beraldo, parassitologa dell’Università di Udine (Lapini et al, 2009). Nonostante ciò, gli sciacalli italiani sembrano ospitare una comunità di endo-parassiti piuttosto povera.
Problemi di conservazione
Il principale problema di conservazione della specie in Italia è sicuramente l’elevata mortalità stradale, ma anche il bracconaggio, condotto sia con armi da fuoco, sia con la dispersione di esche avvelenate. La Legge Nazionale 157/1992 protegge totalmente Canis aureus in Italia, come accade in Svizzera, Germania, Polonia, Macedonia ed Albania. Nonostante ciò in molti altri paesi europei la specie è sottoposta a prelievi legali, con misure di gestione molto variabili da un paese all’altro. L’ibridazione tra lupi, cani e sciacalli dorati, a basse densità popolazionali aneddoticamente indicata per la Bulgaria, la Croazia (Moura et al. 2014; Galov et al. 2015) e per il Caucaso (W. Bogdanowicz, com. pers.), in Italia non è ancora mai stata accertata. Per il momento, comunque, soltanto una giovane femmina con un’unghia bianca su una zampa anterore è stata sottoposta a verifica ibridologica bio-molecolare. I risultati sembrano al momento escludere eventi di ibridazione col cane o col lupo (R. Caniglia/ISPRA com. pers.; W. Bogdanowicz, com. pers.).
Le stime più prudenti disponibili indicano che in Italia la specie mostra evidenti tendenze all’espansione areale, con un deciso incremento recente dei gruppi riproduttivi in tutto il settentrione. A giudicare dai dati pubblicati tra 2016 e 2021 la popolazione italiana in questo periodo (Lapini et al., 2016, 2018, 2020, 2021) sarebbe aumentata di quattro cinque volte, espandendo nel contempo l’areale verso Sud di quasi 200 chilometri.
Fonti citate
-Aukenthaler H., 2019. Totgebissener Goldschakal gefunden/Sciacallo dorato vittima di attacco mortale. Jaeger Zeitung/Giornale del cacciatore-Periodico dell’Associazione Cacciatori Alto Adige, Maggio 2019 (2): 28-29.
-Bregoli M., Pesaro S., Beraldo P., Filacorda S., Fanin Y., Bille L., Lapini L., Benedetti P., Binato G., 2018. Descrizione di un episodio di avvelenamento di esemplari di sciacallo dorato (Canis aureus moreoticus).
36° Rencontres du GEEFSM 2018, Réserve d’Orlu, Dep. De l’Ariège, France, Recueil de Résumés: 9. https://www.researchgate.net/publication/327768577_214_Bregoli_M_Pesaro_S_Beraldo_P_Filacorda_S_Fanin_Y_Bille_L_Lapini_L_Benedetti_P_Binato_G_2018_Descrizione_di_un_caso_di_avvelenamento_di_esemplari_di_sciacallo_dorato_Canis_aureus_moreoticus_Recueil
-Demeter A., Spassov N., 1993. Canis aureus Linnaeus, 1758 – Schakal, Goldschakal. In: Stubbe M. and Krapp F. (eds) Handbuch der Säugetiere Europas: Raubsäuger (Teil I). Aula-Verlag, Wiesbaden: 107–138.
-Fenton S., Moorcroft P. R., Ćirović D., Lanszki J., Heltai M., Cagnacci F., Breck S., Bogdanović N., Pantelić I., Ács K. & Ranc N., 2021. Movement, space‑use and resource preferences of European golden jackals in human‑dominated landscapes: insights from a telemetry study. Mammalian Biology https://doi.org/10.1007/s42991-021-00109-2
-Galov A., Fabbri E., Caniglia R., Arbanasić H., Lapalombella S., Florijančić T., Bošković I., Galaverni M. & Randi E., 2015. First evidence of hybridization between golden jackal (Canis aureus) and domestic dog (Canis familiaris) as revealed by genetic markers. Royal Society open science, 2 (12): 150450.
-Hatlauf J., Banea O. & Lapini L., 2016. Assessment of golden jackal species (Canis aureus, L. 1758) records in natural areas out of their known historic range. Technical Report: GOJAGE Criteria and Guidelines.–GOJAGE E-Bulletin 12.02. https://www.researchgate.net/publication/294430912_Assessment_of_golden_jackal_species_Canis_aureus_L1758_records_in_natural_areas_out_of_their_known_historic_range
-Krofel M., Giannatos G., Ćirović D., Stoyanov S., Newsome T. M., 2017. Golden jackal expansion in Europe: A case of mesopredator release triggered by continent-wide wolf persecution? Hystrix, 28 (1):1–7.
-Kryštufek B., Murariu D., Kurtonur C., 1997. Present distribution of the Golden Jackal Canis aureus in the Balkans and adjacent regions. Mammal Review, 27 (2): 109-114.
-Lange P., Lelieveld G. & De Knegt H. J., 2021. Diet composition of the golden jackal Canis aureus in south- east Europe – a review. Mammal Review, September 2020, DOI: 10.1111/mam.12235.
-Lapini L., 2019. Nuove presenze, problemi vecchi: il caso dello sciacallo dorato in Italia. Habitatonline, Novembre 2019 https://www.habitatonline.eu/2019/11/nuove-presenze-problemi-vecchi-il-caso-dello-sciacallo-dorato-canis-aureus-in-italia/
-Lapini L., 2003. Canis aureus (Linnaeus, 1758). In: Boitani L., Lovari S., Vigna Taglianti A. (Cur.), 2003. Fauna d’Italia. Mammalia III. Carnivora-Artiodactyla. Calderini publ., Bologna: 47-58.
-Lapini L., Caldana M. & Amori G., 2016. Evolution and trends of the populations of Canis aureus moreoticus in Italy. In: Chirichella R., Imperio S., Molinari A., Sozio G., Mazzaracca S., Preatoni D.G. (Eds.) 2016. X Congr. It. Teriologia. Hystrix, the Italian Journal of Mammalogy 27 (Supplement): 110. https://www.researchgate.net/publication/301542516_Lapini_L_Caldana_M_Amori_G_2016_Evolution_and_trends_of_the_populations_of_Canis_aureus_moreoticus_in_Italy
-Lapini L., Perco Fa., 1988. Primi dati sullo sciacallo dorato (Canis aureus Linnaeus, 1758) in Italia (Mammalia, Carnivora, Canidae). Atti del I Conv. Naz. dei Biologi della Selvaggina, Suppl. Ric. di Biol. della Selvaggina, 14:627-628.
-Lapini L., Perco Fa., 1989. Lo sciacallo dorato (Canis aureus L.,1758), specie nuova per la fauna italiana (Mammalia, Carnivora, Canidae). Gortania-Atti Museo Friul. Storia Nat., 10(88):213-228.
-Lapini L., Perco Fa., Benussi E., 1993. Nuovi dati sullo sciacallo dorato (Canis aureus,1758) in Italia (Mammalia, Carnivora, Canidae). Gortania-Atti del Museo Friulano di Storia Naturale, 14 (92): 233-240.
-Lapini L., Molinari P., Dorigo L., Are G., Beraldo P., 2009. Reproduction of the golden jackal (Canis aureus moreoticus I. Geoffroy Saint Hilaire, 1835) in Julian Pre-Alps with new data in its range-expansion in the High-Adriatic Hinterland (Mammalia, Carnivora, Canidae). Bollettino del Museo Civico di Storia Naturale di Venezia, 60: 169–186.
-Lapini L., Dorigo L., Glerean P. & Giovannelli M. M., 2014. Status di alcune specie protette dalla Direttiva Habitat 92/43 CEE nel Friuli Venezia Giulia (Invertebrati, Anfibi, Rettili, Mammiferi). Gortania. Botanica, Zoologia, 35: 61-140.
-Lapini L., Conte D., Zupan M. & Kozlan L., 2011. Italian jackals 1984-2011. An updated review (Canis aureus: Carnivora, Canidae). Boll. Mus. Civ. St. Nat. Venezia, 62 (2011): 219-232.
-Lapini L., Dreon L., Caldana M. & Villa M., 2018. Distribuzione, espansione e problemi di conservazione di Canis aureus in Italia (Carnivora, Canidae). Quaderni del Museo Civico di Storia Naturale di Ferrara , 6 (2018) : 89-96.
-Lapini L., Zanetti A., Salvelli A., Brugnoli A., Nonnis Marzano F., Ferrais D. & Mancassola M., 2020. Lo sciacallo dorato (Canis aureus Linnaeus, 1758) tra il Lago di Garda e la città di Verona (Carnivora: Canidae). Memorie del Museo Civico di Storia Naturale di Verona – 2° Serie. Monografie Naturalistiche, 6 (2020): in stampa.
-Melbert S., 2012. Spatiotemporal competition patterns of Swedish roe deer and wild boar during the fawning season. Master Thesis in Wildlife Ecology, Advanced level D Independent project/Degree project / SLU, Department of Ecology 2012:7, Grimsö and Uppsala, Sweden. https://www.semanticscholar.org/paper/Spatiotemporal-competition-patterns-of-Swedish-roe-Melberg/95f634e573709e5454ebd807b4c0de9a6c0a26c7
-Moura A. E., Dabrowski M. J., Tsingarska E., Jedrzejewska B., Czarnomska S. D. & Pilot M., 2014. Unregulated hunting and genetic recovery from a severe population decline: the cautionary case of Bulgarian wolves. Conserv Genet (2014) 15:405–417. DOI 10.1007/s10592-013-0547-y
-Pecorella S., Lapini L., 2015. Camera-trapping of the golden jackal (Canis aureus moreoticus): data from Italian Karst (north-eastern Italy, Gorizia Province). Bollettino del Museo Civico di Storia Naturale di Venezia, 65 (2014): 215-227.
-Rocca M., Brugnoli A. & Lapini L., 2021. Un primo gruppo riproduttivo di Canis aureus in Provincia di Trento (Italia nord.orientale). Habitatonline, Febbraio 2019. https://www.habitatonline.eu/2021/02/un-primo-gruppo-riproduttivo-di-canis-aureus-in-provincia-di-trento-italia-nord-orientale/
-Spassov N. & Acosta Pankov I., 2019. Dispersal history of the golden jackal (Canis aureus moreoticus Geoffroy, 1835) in Europe and possible causes of its recent population explosion. Biodiversity Data Journal, 7: e34825.
-Torretta E., Dondina O., Delfoco C., Riboldi L., Orioli V., Lapini L., Meriggi A., 2020. First assessment of habitat suitability and connectivity for the golden jackal in north-eastern Italy. Mammalian Biology, https://doi.org/10.1007/s42991-020-00069-z, published on line on October, 6th, 2020.
-Trouwborst A., Krofel M., Linnell J.D.C., 2015. Legal implications of range expansions in a terrestrial carnivore: the case of the golden jackal (Canis aureus) in Europe. Biodivers. Conserv., 24(10):2593–2610.
Riconoscimento della specie
- Diagnosi craniale: forniamo una scheda di studio craniale utilizzata per la determinazione di un cranio di sciacallo rinvenuto in Provincia di Treviso, al fine di richiederne l’affidamento

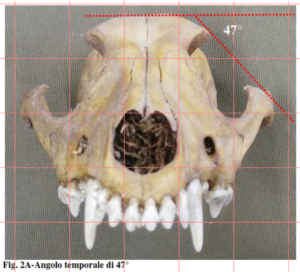



B-Considerazioni di genere sessuale
Le principali misure craniali per discriminare il sesso in Canis aureus sono le seguenti:
Nell’esemplare
Lz (Larghezza zigomatica)
Distanza massima fra le arcate zigomatiche
Lr (Larghezza rostrale)
Massima larghezza del rostro all’altezza degli alveoli dei canini
Cbl (Condilo Basal Lenght
Lunghezza Condilo Basale – Lunghezza del cranio misurata dai condili articolari dell’occipitale
all’apice dei mascellari (anche definita lunghezza gnathion-henselion)
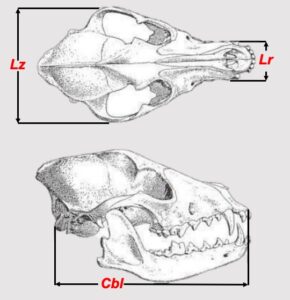
Nell’esemplare di Cava Montesel (TV) queste misure sono molto ridotte, rientrando nell’ambito di
variabilità delle femmine:
-Lz: 80,5 Larghezza zigomatica ridotta
-Lr: 19,6 Larghezza rostrale estremamente ridotta
-Cbl: 148,6 Lunghezza Condilo Basale molto ridotta
Nell’esemplare in parola, inoltre, la cresta sagittale è molto bassa, carattere di sesso femminile.
C-Età stimata dell’animale
Le radici dei canini totalmente obliterate (si chiudono a un anno di vita) e le suture rostrali fortemente saldate indicano che l’età dell’animale è superiore ai due anni.
Si tratta quasi certamente di una femmina riproduttiva.
Riconoscimento della specie dal fenotipo esterno
Diagnosi dal fenotipo esterno: forniamo di seguito dettagli per distinguere la specie in natura nel corso di un avvistamento






Le impronte sono raramente utilizzabili in campagna, essendo molto simili a quelle di volpe e cane



2 commenti su “Lo sciacallo dorato (<em>Canis aureus</em>) in Italia: sintesi delle conoscenze aggiornata al 2021”
I commenti sono chiusi.